
1.氧化还原反应的本质:有电子转移(得失)
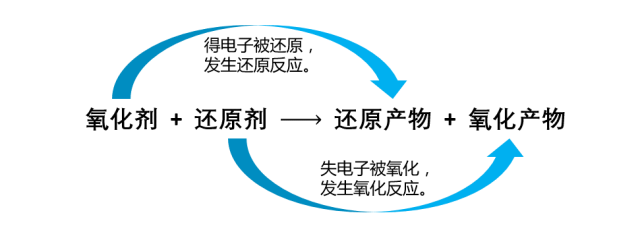
氧化还原反应概念图
2.氧化还原反应的特征:元素化合价的变化
应用:在化学方程式中标出各物质组成元素的化合价,只要有一种元素的化合价发生了变化,即可说明该反应是氧化还原反应。
口诀:升失氧氧还原剂,降得还还氧化剂(化合价上升,失电子,发生氧化反应,被氧化得到氧化产物,在反应中做还原剂;化合价下降,得电子,发生还原反应,被还原得到还原产物,在反应中做氧化剂)。
3.化学反应的分类
我们把化学反应按是否发生电子转移分成两大类:氧化还原反应和非氧化还原反应。下面我们来介绍氧化还原反应与四种基本反应类型的关系:
①置换反应
置换反应是单质与化合物反应生成新单质和新化合物,该过程一定伴随着电子得失,故一定是氧化还原反应。如我们熟悉的
Fe + CuSO4 == FeSO4 + Cu,
铁失2个电子生成亚铁离子,同时,铜离子得两个电子生成铜单质。
②复分解反应
与置换反应性质完全相反地,复分解反应是两种化合物互相交换成分,并不存在电子转移,故一定不是氧化还原反应。如
HCl + NaOH == NaCl + H2O.
③化合反应和分解反应
而化合反应和分解反应既可能是氧化还原反应,如:
C + O2 =点燃= CO2;
2H2O2 =(MnO2)= 2H2O + O2↑;
又可能是非氧化还原反应,如:
CaO + H2O == Ca(OH)2 ;
2NaHCO3 =△= Na2CO3 + H2O + CO2↑.
④当然,我们可以将上述关系用Venn图表示:

氧化还原反应与四种基本反应关系图
4.有关氧化还原的判断
①判断氧化性和还原性
I. 元素处于最高价态时,只有氧化性;
II. 元素处于最低价态时,只有还原性;
特殊地,金属的最低价态为0价,没有负价,故金属单质只有还原性;
III.元素处于中间价态时,既有氧化性又有还原性。
②判断氧化剂和还原剂
I. 常见的氧化剂及其对应的还原产物
i. 活泼非金属单质
X2 → X-(X表示F、Cl、Br、I等卤素)
O2 → O2- / OH- / H2O
ii. 具有处于高价态元素的化合物
MnO2 → Mn2+
H2SO4 → SO2 / S
HNO3 → NO / NO2
KMnO4(酸性条件) → Mn2+
FeCl3 → Fe2+ / Fe
iii.其他
H2O2 → H2O
II. 常见的还原剂及其对应的氧化产物
i. 活泼的金属单质
Na → Na+
Al → Al3+
ii. 活泼的非金属单质
H2 → H2O
C → CO / CO2
iii.具有处于低价态元素的化合物
CO → CO2
SO2 → SO3 / SO42-
H2S → S / SO2
HI → I2
Na2SO3 → SO42-
FeCl2 → Fe3+
网站内容来自网络,如有侵权请联系我们,立即删除!
Copyright © 扑面百科 琼ICP备2024039828号-19